Teori Atom : Pengertian - Rumus dan contoh Soal Penyelesaian - jessipermata
BAB
TEORI
ATOM
1. Menurut
Demokritus
Partikel yang tidak dapat di bagi lagi dinamakan atau disebut atom.
2. Menurut
John Dalton
Pada
tahun 1803 ( 1766 sampai 1844 ) John Dalton seorang ahli kimia berkebangsaan
Inggris memberikan pendapatnya tentang teori atom yaitu :
a. Atom
merupakan bagian terkecil yang tidak dapat dibagi-bagi lagi
b. Atom
suatu unsur tidak dapat berubah menjadi atom lain.
c. Beberapa
atom bisa bergabung menjadi molekul secara proporsional menurut perbandingan
tertentu ( hal ini sesuai dengan Hukum Proust )
d. Atom
tidak akan bisa diciptakan maupun dimusnahkan
Kelebihan teori atom Dalton :
Teori Dalton dapat menjelaskan
hukum kekekalan massa ( Hukum Lavoisier ) dan hukum perbandingan tetap ( Hukum Proust )
dan John Dalton disebut Bapak pencetus atau penggagas teori atom modern
Kelemahan teori atom Dalton :
a. Tidak
dapat menjelaskan sifat kelistrikan materi
b. Tidak
dapat menjelaskan perbedaan antara atom unsur yang satu dengan atom unsur yang
lain
c. Tidak dapat menjelaskan cara-cara atom saling berikatan
3. Teori
atom Thomson
Sir Joseph John Thomson yang
di kenal dengan JJ Thomson dibantu oleh Lord Kelvin disebuah laboratorium
Cavendish Universitas Cambridge Inggris berhasil memperbaiki teori atom Dalton.
Beliau merumuskan model atomnya yang terkenal dengan nama kue kismis di tahun
1897. Penemuannya dapat disimpulkan yaitu :
a. Atom
bukan merupakan bagian terkecil suatu zat
b. Atom
berbentuk bola dengan muatan positif dan negative yang tersebar merata pada
seluruh permukaan bola
c. Jumlah
muatan positif = jumlah muatan negative, sehingga atom bersifat netral
d. Massa
electron jauh lebih kecil dari massa atom secara keseluruhan.
Kelebihan Teori atom Thomson :
a. Dapat
menerangkan sifat listrik atom
b. Dapat
menerangkan adanya partikel yang lebih kecil dari atom yang disebut sub atomik
Kelemahan
Teori atom Thomson :
a. Tidak
mampu menjelaskan mengenai inti atom
b. Tidak
dapat menjelaskan terjadinya spektrum gas hydrogen seperti yang diterangkan
oleh Bohr
c. Tidak
dapat menjelaskan susunan muatan positif dan jumlah elektron
yang berada di dalam bola atom.
Pada tahun 1911 Ernest Rutherford mengadakan suatu
percobaan untuk menguji kebenaran model atom Thomson. Beliau mengadakan
penelitian dengan menembakkan pertikel alfa ( partikel positif ) pada suatu
lempeng emas yang sangat tipis dengan ketebalan ± 0,01 mm ( tebalnya setara 2000 atom ).
Bila model atom Thomson benar, maka
partikel-partikel alfa tidak akan dihamburkan pada saat menumbuk lempengan
emas. Tetapi pada kenyataannya saat di lakukan percobaan ditemukan adanya
fakta:
1.
Partikel-partikel alfa ada yang di belokkan
2.
Partikel-partikel alfa ada yang di pantulkan
3.
Partikel-partikel alfa ada yang menembus
lempeng
Fakta ini menunjukkan adanya
bagian atom yang sangat keras
( bermuatan positif ) karena tolak menolak dengan partikel
alfa. Muatan- muatan positif mengumpul menjadi satu.
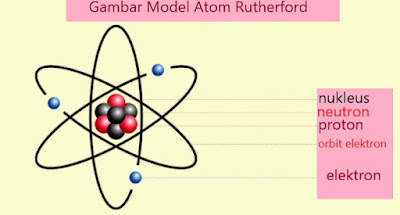
Kesimpulan dari Teori Atom Rutherford :
a. Atom
terdiri dari inti atom bermuatan positif ( letaknya di Pusat atom ) dan massa
terkuantisasi di inti atom.
b. Electron
mengorbit pada inti atom seperti model tata surya.
c. Atom
bersifat netral.
d. Selama
mengelilingi inti atom, gaya sentripental pada electron dibentuk oleh gaya
tarik elektrostatik ( gaya coulomb )
Kelebihan
Teori atom Rutherford:
a. Mudah
di pahami untuk menjelaskan struktur atom yang rumit.
b. Dapat
menjelaskan bentuk lintasan electron yang mengelilingi inti atom.
c. Dapat
menggambarkan gerak electron di sekitar inti.
Kelemahan Teori atom Rutherford:
a. Belum
mampu menjelaskan di letak electron di dalam atomdan cara rotasinya terhadap
inti atom
b. Electron
memancarkan energi Ketika bergerak sehingga energi atom menjadi tidak stabil
c. Tidak
dapat menjelaskan spektrum garis pada atom hydrogen.
Untuk mengelilingi inti atom ,
electron membutuhkan energi. Besar energi total electron ( ET ) sama dengan energi potensial ( EP
) ditambah energi kinetic (Ek).
Keterangan :
ET = energi total
electron ( J )
e = muatan electron
e = -1,6.10-19 C
r = jari-jari lintasan stasioner ( m )
k = konstanta gaya coulomb
k = 9 . 109 Nm2/C2
1.
Teori Atom Bohr (1913 )
Spektrometer : alat yang digunakan untuk melihat spektrum
dari suatu sumber cahaya.
Bohr memakai sumber cahaya yaitu lampu hydrogen.
Hasil Percobaan :
Terjadi spektrum garis atom hydrogen ( bukan spektrum
kontinu ).
Kesimpulan Teori atom Bohr:
a. Electron
mengelilingi inti tidak pada sembarang lintasan tetapi pada lintasan tertentu
yang stasioner. Pada lintasan ini electron tidak menyerap atau memancarkan
energi.
b. Electron
berpindah antar lintasan akan menyerap atau memancarkan memancarkan energi. Jika
electron berpindah dari kulit dalam ke kulit luar maka electron akan menyerap
energi. Sebaliknya Jika electron berpindah dari kulit luar ke kulit dalam maka electron
akan memancarkan energi. Energi yang
dipancarkan atau diserap ketika elektron berpindah-pindah kulit disebut foton.
Kelebihan Teori atom Bohr :
a. Dapat
menyempurnakan kelemahan teori atom Rutherford.
b. Data
menjelaskan tentang spektrum atom hydrogen
c. Dapat menjelaskan bahwa atom terdiri dari kulit-kulit dengan tingkat energi tertentu.
Kelemahan Teori atom Bohr :
a. Lintasan
elektron sebenarnya masih mempunyai sub kulit orbital sehingga lintasannya
bukan berupa lingkaran saja tapi juga berupa elip.
b. Hanya mampu menjelaskan
spektrum atom sederhana seperti hidrogen dan tidak dapat menjelaskan atom-atom
yang lebih kompleks.
c. Bohr menganggap
elektron hanya sebagai partikel bukan sebagai partikel dan gelombang, sehingga
kedudukan elektron dalam atom merupakan kebolehjadian.
d. Tidak dapat
menerangkan efek Zeeman yaitu pemisahan sebuah garis spektrum menjadi beberapa
bagian akibat medan magnet.
Rumus :
Momentum sudut electron ( L )
Jari – jari Lintasan electron ( r ):
rn = n2 r1
untuk n = 1, r1 = 5,28 . 10-11 m
sehingga :
rn = n2( 5,28 . 10-11) dan ∆r = rbesar
– rkecil
Energi tiap Lintasan Elektron ( E )
Untuk atom hydrogen
Contoh :
Unsur Na → Z = 11
Keterangan :
L = momentum sudut electron ( kg m2/s )
r = jari-jari lintasan electron ( m )
n = bilangan kuantum utama ( kulit electron )
h = konstanta Planck = 6,6261 . 10-34
Js
E = energi electron ( Joule )
M = massa electron atom (kg)
Energi Antar Lintasan / energi yang dilepas
atau diserap / energi eksitasi ( ∆E )
Ketentuan
:
∆E = negatif
( - )
2. Bila
electron datang dari kulit luar ke kulit
dalam maka electron akan memancarkan
energi gelombang elektromagnetik.
∆E = positif ( + )
Rumus :
Soal – soal :
1. Tentukan
momentum sudut sebuah electron pada lintasan n = 2 ( 6,6 . 10-34 Js
)
2. Tentukan
jari-jari lintasan electron atom pada lintasan n = 4
(r1 = 5,3. 10-11 m )
3. Menurut
model atom Bohr, jika electron pada atom hydrogen bertransisi dari keadaan
kulit n ke keadaan kulit ( n-2 ) , maka perubahan radius ( jari-jari electron )
atom hidrogen adalah …
4. Berapa
energi gelombang elektromagnetik yang dipancarkan oleh sebuah atom hydrogen yang
berpindah dari lintasan n=5 ke lintasan n = 1.
5. Tentukan
energi yang diserap oleh sebuah atom hydrogen yang berpindah dari kulit n = 2
ke kulit n = 4.
6. Tentukan
energi total electron atom hydrogen untuk n = 2.
7. Tentukan
energi total electron atom natrium ( Z = 11 )untuk n = 2.
Spektrum Garis Atom Hidrogen
Rumus :
1. Untuk deret
Lyman ( Tahun 1906 )
ntujuan
= 1
nasal
= 2,3,4,5,…, ∞
λterpanjang untuk nasal = 2
λterpendek untuk nasal = ∞
2. Untuk deret
Balmer ( Tahun 1885 )
ntujuan = 2
nasal = 3,4,5,6,…, ∞
λterpanjang untuk nasal = 3
λterpendek untuk nasal = ∞
3. Untuk deret
Paschen ( Tahun 1905 )
ntujuan = 3
nasal = 4,5,6,7,…, ∞
λterpanjang untuk nasal = 4
λterpendek untuk nasal = ∞
4. Untuk deret
Bracket ( Tahun 1922 )
ntujuan
= 4
nasal
= 5,6,7,8,…, ∞
λterpanjang untuk nasal = 5
λterpendek untuk nasal = ∞
5. Untuk deret
Pfund ( Tahun 1924 )
ntujuan
= 5
nasal
= 6,7,8,9,…, ∞
λterpanjang untuk nasal = 6
λterpendek untuk nasal = ∞
Soal :
1. Tentukan
Panjang gelombang terpanjang dan Panjang gelombang terpendek dari deret Balmer.
2. Tentukan
Panjang gelombang terpanjang dan Panjang gelombang terpendek dari deret Pfund.






















Post a Comment for "Teori Atom : Pengertian - Rumus dan contoh Soal Penyelesaian - jessipermata"